Choć badania kliniczne w obiegowej opinii często określane są mianem eksperymentów medycznych, to w rzeczywistości nierzadko ratują życie ludziom poważnie chorym. Najczęściej po tę opcję sięgają pacjenci niemogący liczyć na żadne refundowane leczenie, a zmagający się z chorobą śmiertelną lub znacznie pogarszającą jakość życia. Polska uchodzi za dobre miejsce do prowadzenia takich badań i ugruntowuje swoją pozycję na globalnym rynku. Mimo to świadomość o istnieniu i dostępności badań jest niezadowalająca. Dotyczy to nie tylko pacjentów, ale i lekarzy podstawowej opieki zdrowotnej oraz ambulatoryjnej opieki specjalistycznej.
– Pacjenci w Polsce bardzo chętnie biorą udział w badaniach klinicznych. Musimy pamiętać, że nasz system opieki zdrowotnej jest bardzo mocno niedofinansowany, w związku z tym możliwość udziału w badaniu klinicznym bardzo często dla wielu grup pacjentów jest jedyną możliwością otrzymania innowacyjnej terapii, w szczególności dotyczy to takich grup jak onkologia, hematologia czy choroby rzadkie – mówi w wywiadzie dla agencji Newseria Innowacje Agnieszka Kulesza, członkini zarządu, dyrektor operacyjna Biokinetiki, ośrodka badań klinicznych wczesnej fazy z centrum operacyjnym w Warszawie.
O udział w badaniach klinicznych pacjenci starają się najczęściej wówczas, gdy w ich jednostce chorobowej nie ma opcji terapeutycznej objętej refundacją lub gdy żadna z refundowanych terapii nie przyniosła poprawy stanu zdrowia. W niektórych przypadkach terapia jest testowana z grupą kontrolną otrzymującą placebo, w innych grupa kontrolna otrzymuje jeden z leków już wcześniej zarejestrowanych. Ta druga opcja jest standardem w przypadku nowotworów.
– Badania kliniczne są niezbędnym i kluczowym elementem rozwoju każdego leku, czy to będzie lek innowacyjny, czy to będzie lek biopodobny, i jest to krytyczne z punktu widzenia tego, czy lek, który będzie dostępny w szpitalach czy aptekach, będzie bezpieczny i będzie skuteczny. Z tego punktu widzenia proces projektowania i planowania badań klinicznych, ocena ryzyka w trakcie tego planowania są bardzo istotne, podobnie jak wybór partnerów, z którymi będzie się te badania kliniczne prowadzić, czy to firmy CRO [Contract Research Organization, specjalizujące się w organizacji i nadzorowaniu badań klinicznych, zazwyczaj na zlecenie firm farmaceutycznych – red.], czy ośrodki, czy w ogóle kraj, w którym będzie się te badania prowadzić, czy będziemy mieli dostęp do danej grupy pacjentów, czy zdrowych ochotników – wymienia Agnieszka Kulesza.
Badania kliniczne dzieli się na komercyjne, w których sponsorem jest producent leku, oraz niekomercyjne – prowadzone przez rządowe agendy. W Polsce za prowadzenie konkursów na realizację niekomercyjnych badań klinicznych i zwiększanie ich udziału odpowiedzialna jest założona w 2019 roku Agencja Badań Medycznych. W momencie powstania ABM udział niekomercyjnych badań klinicznych wynosił w Polsce 2 proc., podczas gdy w krajach Europy Zachodniej było to 40 proc.
– Polska ma ogromny potencjał do prowadzenia badań klinicznych wszystkich faz. Jesteśmy od ponad 20 lat rozpoznawani jako miejsce z bardzo dobrym dostępem do pacjentów, którzy mogą wziąć udział w badaniach klinicznych. Jesteśmy top rekruterem w badaniach klinicznych, czyli rekrutujemy najszybciej. Mamy doświadczonych lekarzy, badaczy, którzy na co dzień pracują w szpitalach, w publicznych, ale również w prywatnych ośrodkach. Ten rynek rośnie z roku na rok i mamy również nadzieję, że część regulacyjna, czyli możliwość uzyskiwania zgód na badania kliniczne w szybszym tempie, będzie również możliwa – ocenia ekspertka Biokinetiki.
Na całym świecie toczy się obecnie prawie 490 tys. różnego typu badań klinicznych. Jak podaje ABM za INFARMĄ, Polska w ciągu ostatnich dwóch dekad ugruntowała swoją pozycję na globalnym rynku biofarmaceutycznych komercyjnych badań klinicznych. W 2019 roku pod względem udziału w nim zajmowała 11. pozycję, a w latach 2014 – 2019 zanotowała jeden z najwyższych wskaźników wzrostu tego udziału, plasując się za Chinami, Hiszpanią, Koreą Południową i Tajwanem. Od 2019 roku widać wyraźne przyspieszenie w liczbie rejestrowanych co roku badań. O ile w latach 2010–2018 było ich ok. 400 rocznie, o tyle od 2019 roku jest ich 600–680 (wyjątkiem był pandemiczny 2020 rok). Z danych przytaczanych przez ABM za URPL wynika, że w 2023 roku zarejestrowano ponad 780 badań.
Głównym obszarem badań klinicznych zarejestrowanych w 2022 roku w Polsce była onkologia (23 proc.). Na kolejnych miejscach znalazły się neurologia (12 proc.), dermatologia (10 proc.) oraz kardiologia (8 proc.). Choroby autoimmunologiczne stanowiły 1 proc. zarejestrowanych badań.
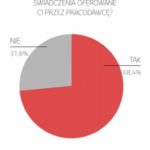
Choć Polska jest uznawana za jedno z najlepszych miejsc do rekrutowania uczestników i prowadzenia badań, to wciąż są wyzwania wynikające z tego, że nie wszyscy potencjalni pacjenci wiedzą o takiej opcji.
– Bardzo ważne jest, żebyśmy jako przemysł uczestniczący w badaniach klinicznych i firmy zaangażowane w ich prowadzenie informowali lekarzy, począwszy od lekarzy rodzinnych, jak ważna jest możliwość wzięcia udziału w badaniach klinicznych przez pacjentów. Często to są pacjenci, którzy nie mają już dostępu do żadnej standardowej terapii, w związku z tym pierwszym punktem informacji o badaniu klinicznym powinien być lekarz pierwszego kontaktu bądź lekarz specjalista. Bardzo ważna jest więc kwestia edukacji lekarzy. Oczywiście w momencie, w którym pacjent trafia już do ośrodka badań klinicznych, wtedy uzyskuje pełną informację, która jest przekazywana przez doświadczonego badacza – mówi Agnieszka Kulesza. – To, co może być problematyczne, to brak jednej centralnej bazy danych badań klinicznych, ale jako branża pracujemy nad tym, aby taka informacja w języku polskim była dostępna dla wszystkich pacjentów.
Według Fortune Business Insights światowy rynek badań klinicznych był w 2023 roku wart prawie 58 mld dol. Do końca dekady przychody mają przekroczyć 92 mld dol.